En electroquímica, se aplica un potencial específico sobre un electrodo de trabajo para permitir que se produzca una reacción específica. El potencial de un electrodo de trabajo debe especificarse siempre exactamente. Esa es la razón por la que se requiere un electrodo de referencia como referencia del potencial.

Normalmente, se utiliza un pequeño tubo de vidrio (a veces tubular de teflón para anticorrosión) como el recipiente para estos tres componentes. La frita se encuentra en el extremo del tubo para contacto eléctrico con la solución de prueba. El requisito de un electrodo de referencia es una estabilidad a largo plazo en constante indicación de potencial. Para eso, no se debe permitir que la corriente eléctrica fluya a través del electrodo de referencia. Dado que el flujo de corriente puede causar un desvío de potencial, se desea que se conecte un electrodo de referencia a un circuito de alta impedancia. El potenciostato tiene un terminal de conexión de electrodo de referencia que es un terminal de alta impedancia de entrada. Por lo tanto, el flujo de corriente está estrictamente limitado a través de un electrodo de referencia.
Aunque solo se conecta un cable de platino, que está sumergido en una solución de prueba, al terminal de referencia del potenciostato hace contacto eléctrico con la solución de prueba, el llamado electrodo de pseudo-referencia, pero eso no podría garantizar la estabilidad o reproducibilidad de la medición de potencial. Podría ser digno de notar que la medición reproducible solo es posible conectando un electrodo de referencia confiable.
Aunque la corriente eléctrica no fluye a través del electrodo de referencia, la impedancia interna del propio electrodo de referencia es lo más pequeña posible. Como el potenciostato es un sistema de control automático, que involucra un componente de alta impedancia en el bucle de retroalimentación resulta en una disminución de la tasa de respuesta (en otras palabras, estrechamiento del ancho de banda), luego se desestabiliza a la oscilación. Es necesario evitar la formación de depósitos en la frita ubicada en el extremo del electrodo de referencia, lo que podría resultar en una impedancia extremadamente alta del electrodo de referencia.
El electrodo de hidrógeno estándar (SHE) es un estándar primario de potencial, pero no es necesariamente conveniente para el uso diario debido a la problemática manipulación del gas de hidrógeno. En lugar de SHE, como electrodos de referencia secundarios, electrodo de calomel saturado (SCE), electrodo de cloruro de plata y plata (SSCE) y electrodo de hidrógeno reversible (RHE), etc., son bien conocidos y utilizados.
La razón es que una reacción redox en la superficie del electrodo ocurre de manera reversible y se equilibra todo el tiempo como se muestra a continuación.
ELLA H 2 ⇔ 2H + + 2e - (0V)
SCE Hg + Cl - ⇔ 1 / 2HG 2 Cl 2 + e - (+ 0.24V)
SSCE Ag + Cl - ⇔ AgCl + e - (+ 0.20V)
El electrodo, que puede consistir en un par redox en equilibrio, se llama electrodo de referencia. El potencial de un electrodo de referencia no se puede cambiar externamente, por lo que se denomina electrodo no polarizable. Por el contrario, platino, oro y carbono, cuyo potencial se puede cambiar externamente, se denominan electrodos polarizables y se utilizan como electrodos de trabajo o de contador (auxiliares).
Dado que los potenciales relativos entre los diversos electrodos de referencia son fijos y bien conocidos, tiene un significado significativo que la comparación entre los datos experimentales obtenidos incluso en lugares y tiempos diferentes es posible si se especifica el electrodo de referencia utilizado.
Se utiliza un electrodo de referencia en equilibrio para que la corriente neta en el circuito conectado al electrodo de referencia sea cero. O más bien debe ser usado bajo corriente cero. El terminal de conexión para el electrodo de referencia en potenciostato tiene una impedancia de entrada extremadamente alta por lo que es imposible que la corriente fluya a través del electrodo de referencia. Esa es una de las funciones importantes del potenciostato.
El electrodo de referencia más utilizado hoy en día es el electrodo de cloruro de plata-plata (SSCE). SSCE es respetuoso con el medio ambiente en comparación con el electrodo de calomel que usa mercurio y su sal. Su estabilidad, fiabilidad y reproducibilidad también son suficientes.
La reacción en SSCE se muestra a continuación.
Ag + Cl - ⇔ AgCl + e - (+ 0.20V)

El potencial de electrodo de la reacción anterior se da como sigue.
E = E 0 Ag + + (RT / F) En una ecuación de Ag + (1) La
sustitución de la actividad del ion plata con la constante de producto de solubilidad de AgCl, K sAgCl da como resultado la ecuación (1) en la siguiente ecuación (2).
E = E 0 Ag + + (RT / F) en K sAgCl - (RT / F) en un Cl - eq. (2)
Usando los valores de la literatura de E 0 Ag + y K sAgCl (E 0 Ag += 0.7991 V, y K sAgCl = [Ag + ] [Cl- ] = 1.6 × 10 -10 ), se obtiene la ecuación conocida (3).
E = 0.222 - (RT / F) En un Cl - eq. (3)
a Cl - es la actividad del ion cloruro en la solución interna del electrodo. Por lo tanto, el potencial de referencia del SSCE depende de la actividad del ion cloruro además de la temperatura. Un aumento de la actividad da como resultado un cambio catódico del potencial. Por lo tanto, mantener la concentración interna de cloruro a constante es importante para obtener resultados reproducibles.
El potencial de referencia de SSCE saturado (en solución saturada de KCl) es de 0.197 V a 25 ℃ en comparación con el electrodo de hidrógeno estándar (SHE). El contacto eléctrico del electrodo de referencia con la solución de prueba se realiza a través de la frita que permite la transferencia mutua entre la solución interna y la solución de prueba. Por lo tanto, la dilución de la solución interna y la contaminación de la solución de prueba a veces proporcionan un problema importante.
En lugar de KCl, a veces se elige NaCl como un electrolito interno. Cuando el anión perclorato interviene en la solución de prueba, el NaCl se emplea a menudo como electrolito interno debido a la baja solubilidad del perclorato de potasio en comparación con la sal de sodio. La deposición de perclorato de potasio dentro de la frita puede causar serios problemas, como un gran aumento de la impedancia del electrodo de referencia.
Una razón principal para usar KCl es que el catión potasio y el anión cloruro tienen una movilidad casi idéntica, de modo que se minimiza el potencial de unión líquida en la interfaz líquida compuesta por estos iones. Mientras tanto, el potencial de unión líquida para el caso de usar NaCl como electrolito interno puede llegar a ser bastante considerable. Cuál es la mejor opción podría depender de un compromiso entre la conveniencia práctica.
El manejo del electrodo de referencia es importante, ya que de lo contrario se produce un cambio del potencial de referencia El electrodo de referencia debe mantenerse en solución de la misma composición de solución interna, mientras que no se utiliza. Debería excluirse la contaminación o la deposición dentro de la frita debido a sustancias externas, ya que de lo contrario se producirían grandes problemas, como la oscilación del potenciostato causado por el ruido externo, etc.
Para la comprobación, si el electrodo de referencia está correctamente, puede medir comparando con el nuevo del mismo tipo.
Dado que el electrodo de referencia en la celda es el mismo, la diferencia de potencial ideal es de 0 voltios, sin embargo, en la práctica, se producirá una pequeña diferencia de potencial.
Puede utilizarse si la diferencia de potencial, entre los electrodos, está dentro de 0 ± 20 mV.
Para la medición, sumerja el electrodo de referencia en una solución de NaCl 3 M o una solución de KCl saturada, y luego mida la diferencia de potencial entre ambos usando un voltímetro.
Referencia: Potencial de diferencia de tipo del electrodo de referencia.
NHE (Normal electrodo de hidrógeno) · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 0 mV
SCE (saturado de calomelanos Electrodo) · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 241mV
SSCE (sodio saturado Calomel Electrode) · · · · · · · · · · · · · · · · · ・ ・ ・ 6
Ag Ag Ag Ag 201mV
Ag / AgCl (saturado KCl) · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 198mV
Hg / HgSO4 (saturado HgSO4) · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · · 616mV
Cu / CuSO4 (saturado CuSO4) · · · · · · M ・ m m m m m m m m m m m 300 mV
La reacción de equilibrio que se muestra a continuación tiene lugar en el electrodo de calomel.
Hg + Cl - ⇔ 1 / 2Hg 2 Cl 2 + e - ( 1 )
El potencial del electrodo se da como la siguiente ecuación.
E = E 0 Hg 2 2 + / Hg + RT / 2F Ln K s (Hg 2 Cl 2 ) - RT / F ln a Cl - ( 2 )
Los dos primeros términos en el lado derecho de la ecuación ( 2 ) se reemplazan por E 0 Hg 2 Cl 2 / Hg que se calcula que es 0.273 V a partir de los valores de la literatura del potencial redox
(E 0 Hg 2 2 + / Hg = 0.7960V) y la constante del producto de solubilidad (K s (Hg 2 Cl 2 )= 2 × 10 -18 ).
Reemplazando nuevamente E 0 Hg 2 Cl 2 / Hg a E 0 , se obtiene la ecuación (3), que es una fórmula familiar que involucra la actividad del ion cloruro.
E = E 0 - (RT / F) En un Cl - ( 3 )
Aunque existe una pequeña discrepancia en el valor calculado anterior, E 0Se conoce como 0.268 V para potencial estándar a 25 ° C. El potencial del electrodo depende de la concentración de ion cloruro como el electrodo de cloruro de plata-plata. Es 0.280 V en 1M KCl y 0.241 V en saturada de KCl que tan a menudo se llama como SCE como abreviatura de S aturated Calomel E lectrode.

El potencial de referencia de SCE es de 0.241 V (a 25 ° C), debido al aumento de la actividad del ion cloruro en una solución interna de KCl saturado (aprox. 4.8 M). Además de la dependencia del potencial a la concentración de cloruro, la dependencia del potencial a la temperatura es de aproximadamente -0.5 mV por grado. Excepto por SCE, los potenciales de referencia son 0.280 V y 0.334 V para KCl 1 M y KCl 0.1 M, respectivamente. Cuanto mayor es la concentración de KCl, mayor es la dependencia de la temperatura del potencial.

A menudo recibimos la pregunta "¿Se puede usar SCE para experimentar con solventes orgánicos?" . La respuesta es "Sí". Sin embargo, en el caso de que no le guste una contaminación con agua o ion cloruro, se recomienda usar un puente salino, en el que se encuentre el mismo disolvente orgánico y electrolito que se utiliza en su solución de prueba. Aun así, hay que prestar atención al hecho de que aún se desconoce un potencial de unión bastante grande entre SCE y el puente salino.Además de eso, considerando un riesgo creciente de deposición en la frita, podría ser mejor usar un electrodo de referencia para solventes no acuosos (como Ag-Ag + en solventes orgánicos) o electrodos de pseudo-referencias (como cables de Pt). ), luego refiérase a la norma interna como el ferroceno.
El uso de pseudo-referencia que se conecta al terminal de referencia del potenciostato es recomendable desde el punto de vista de baja impedancia.
En esta sección, presentamos el otro electrodo de referencia cuando no desea utilizar el electrodo de referencia típico (Ag-AgCl o electrodo de calomel) ya mencionado. Por ejemplo, puede desanimarse a usarlo en los casos en que su solución de prueba debe mantenerse alejada de una contaminación con ion cloruro o es un álcali fuerte o ácido fuerte, etc. En esos casos, tiene la opción de mercurio-mercurio. Electrodo de referencia de óxido (Hg-HgO) para solución alcalina y electrodo de referencia de sulfato mercurio-mercurio para solución ácida o neutra.
Esto se usa para una solución alcalina fuerte. Se utiliza la reacción de equilibrio entre la capa de óxido mercúrico formada en mercurio y anión hidróxido en solución alcalina como solución interna. Las reacciones consecutivas se muestran a continuación.
Hg ⇔ Hg 2+ + 2e - ( 1 )
HgO + H 2 O ⇔ Hg (OH) 2 ⇔ Hg 2+ + 2OH - ( 2 )
El potencial del electrodo para la reacción ( 1 ) se muestra a continuación como ecuación ( 3 ).
E = E 0 Hg / Hg 2+ + (RT / 2F) En un Hg 2+ ( 3 )
Dado que la actividad del ión mercúrico se da utilizando la constante de producto de solubilidad como Hg 2+ = K s (Hg (OH) 2 )/ (a OH - ) 2 , la ecuación ( 3 ) se reemplaza por la ecuación ( 4 ).
E = E 0 Hg / Hg 2+ + (RT / 2F) En K s (Hg (OH) 2 ) - (RT / F) En un OH - ( 4 )
Como se describe en la sección de cloruro de plata-plata, el potencial estándar del electrodo de referencia que utiliza sal altamente insoluble depende significativamente de su constante de producto de solubilidad.
Usando E 0 Hg / Hg 2+ = 0.8537 y K s (Hg (OH) 2 ) ≃ 10 -25 , la ecuación ( 4 ) se da finalmente como se muestra a continuación.
E = 0.116 - (RT / F) En un OH - ( 5 )
Como electrolito interno, se emplean 0.1 M, 1 M, 3 M y una solución saturada de NaOH o KOH. La solución saturada de Ca (OH) 2 o Ba (OH) 2 se usa a veces debido a su baja solubilidad en comparación con NaOH o KOH. Menor OH : la actividad de estas soluciones alcalinotérreas es favorable para el uso de recipientes de vidrio y eleva un poco el potencial estándar. Los potenciales estándar de KOH 1 M, NaOH 1 M, Ba (OH) 2 saturado y Ca (OH) 2 saturado son 110 mV, 113 mV, 146 mV y 192 mV, respectivamente.
La reacción del electrodo y el potencial del electrodo se muestran a continuación.
Hg + 1 / 2SO 4 2- ⇔ 1 / 2Hg 2 SO 4 + e - ( 6 )
E = E 0 Hg / Hg 2 2+ + (RT / 2F) En un Hg 2 2+ ( 7 )
La ecuación ( 7 ) se reemplaza utilizando la relación entre la actividad del ión mercurioso y la constante del producto de solubilidad K s (Hg 2 SO 4 ) ,
(K s (Hg 2 SO 4 ) = [Hg 2 2+ ] [SO 4 2- ]) como sigue.
E = E 0 Hg / Hg 2 2+ + (RT / 2F) En K s (Hg 2 SO 4 ) - (RT / 2F) En un SO 4 2- ( 8 )
Poniendo E 0 Hg / Hg 2 2+= 0.7960 V (25 ° C) y K s (Hg 2 SO 4 ) ≃ 7 × 10 -7 , en la ecuación ( 8 ), la forma final se muestra a continuación.
E = 0.6125 - (RT / 2F) En un SO 4 2- ( 9 )
El potencial de referencia es considerablemente positivo en comparación con el del electrodo de calomel que refleja una solubilidad bastante grande del sulfato de mercurio. Saturada K 2 SO 4 o 1 MH 2 SO 4 se utilizan como electrolito interno.
Este electrodo de referencia es una opción apropiada para el caso para evitar una contaminación del ion cloruro.
Formación de este tipo de electrodo están disponibles de BAS Japón como RE-61AP para el electrodo de Hg-HgO y RE-2CPde Hg-Hg 2 SO 4 electrodo.
| & refx (): Archivo no encontrado: "RE-6AP_b.png" en dir "xdata / ref_electrode /"; RE-61AP |
& refx (): Archivo no encontrado: "RE-2CP_b.png" en dir "xdata / ref_electrode /"; RE-2CP |
En esta sección, describimos sobre un estándar de referencia aplicable para el uso en solventes orgánicos. Los electrodos de referencia ya mencionados para el solvente acuoso también se pueden usar en solventes orgánicos colocando un puente salino apropiado entre la solución de prueba y el electrodo de referencia acuoso. De hecho, la descripción del potencial redox referido a SCE o Ag-AgCl se encuentra en mucha literatura. En muchos de ellos, se han ignorado los potenciales de unión entre el electrodo de referencia acuoso y la solución de prueba orgánica. Por lo tanto, no siempre es una tarea fácil comparar nuestros resultados con el valor de la literatura o evaluar la discrepancia entre literaturas. Por lo tanto, teniendo en cuenta la contaminación inevitable debida al agua y / o el ión cloruro y la implicación de un potencial de unión extra no responsable,
El electrodo de Ag + -Ag se usa en experimentos para solventes no acuosos en general. La estructura básica del electrodo es similar al electrodo de Ag-AgCl. El alambre de plata se inserta en un tubo de vidrio que contiene una pequeña cantidad de sal de plata, un solvente orgánico y una gran cantidad de electrolito. El acetonitrilo se emplea como un solvente interno en la mayoría de los casos. El solvente usado para una solución de analito también se puede usar en muchos casos. El electrolito se selecciona de entre la combinación de tetraalquilamonio R4N + (R = metilo, etilo, propilo y butilo etc.) como catión y perclorato ClO 4 - , hexafluorofosfato PF 6 - y tetrafluoroborato BF 4 - así sucesivamente como anión.
Es mejor utilizar la mayor concentración de electrolito tanto como sea posible dentro del límite de solubilidad (generalmente más de 0.1 M). Además de eso, una pequeña cantidad de sal de plata (0.01 M, la sal con NO 3 - , ClO 4 - , PF 6- y BF 4 - etc.) se solubiliza como fuente de Ag + . La estabilidad y reproducibilidad a largo plazo de este electrodo no siempre es buena. Además de eso, el potencial de referencia depende de los tipos de solventes. Por lo tanto, confiar solo en el electrodo Ag-Ag + no es suficiente para la especificación del potencial redox del compuesto de prueba. IUPAC ( Internacional U nión deP ure y A pplied C hemistry) recomienda utilizar un estándar interno como el ferroceno o el bisfenil cromo (I). El potencial redox de estos compuestos no depende tanto de los tipos de uso de solventes. Se infiere la razón de que el sitio redox de Fe 2 + / 3 + en ferroceno o Cr +1/0 en bisfenilcromo (I) se selecciona de manera eficiente de la influencia del medio circundante debido a que está emparedado por el anillo de pentadienilo o el anillo de fenilo, respectivamente.
Incluso cuando usa el electrodo de referencia Ag-Ag + , debe referirse al potencial redox del ferroceno o bisfenilcromo como estándar de potencial convencional. El bisfenilcromo (I) se utiliza como sal de tetrafenilborato. El potencial redox del ferroceno es de aproximadamente +0.7 V en la escala SHE, el potencial redox del bisfenilcromo (I) es -1.15 V en la escala del ferroceno (aproximadamente -0.45 V en la escala SHE). Tanto las mediciones simultáneas como las contenidas en la solución de prueba como las mediciones posteriores mediante la adición posterior son viables. La virtud de emplear el estándar interno es que una comparación relativa con el potencial en la escala SHE se hace viable a través de la escala de ferroceno.
Aunque el potencial redox de Ag-Ag + (Ag + + e - ⇔ Ag) en solución acuosa se conoce como 0.7991 V vs SHE, este valor cambia en gran medida en el solvente orgánico debido a la diferencia de la energía de solvatación principalmente hacia el catión. Por ejemplo, es 0,65 V en diclorometano, 0,41 V en tetrahidrofurano, 0,04 V en acetonitrilo. A medida que el oxidante (catión) se estabiliza en el solvente polar, el potencial redox se desplaza hacia una dirección negativa dependiendo de la extensión de la desestabilización por el tipo de solvente. Así, Ag-Ag + no acuosoel electrodo de referencia puede no ser apropiado para la especificación del potencial redox del compuesto analito y solo se utiliza como electrodo de referencia. Podría ser recomendable que el potencial redox se refiera al estándar interno en su documento. La dimetilformamida (DMF) y el diclorometano son inapropiados desde el punto de vista de la reactividad o solubilidad del ion Ag + .
El electrodo de pseudo-referencia es una forma de ser considerado. Es solo para conectar el cable Pt sumergido en la solución de prueba al terminal de referencia del potenciostato (ya que el potenciostato tiene un terminal de electrodo de referencia que debe estar conectado) que no debe permanecer abierto. Aunque la especificación del potencial no está garantizada, el cable Pt podría ser una opción, considerando la baja impedancia del mismo y la eliminación del potencial de unión. Por supuesto, es necesario describir la referencia interna utilizada en el caso de publicación.
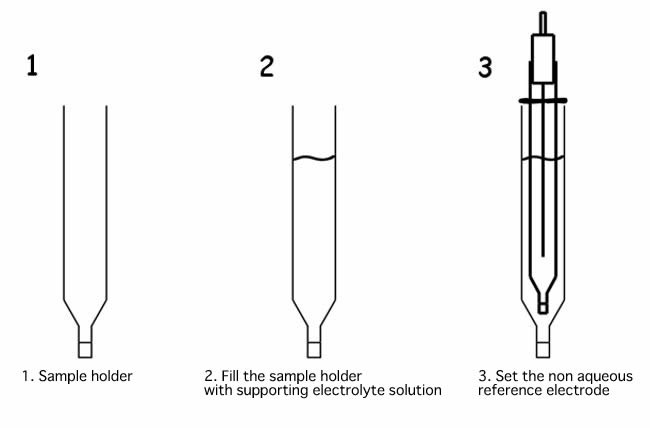
Cuando el electrodo de referencia no acuoso se sumerge directamente en la solución de muestra, el electrolito de soporte de la solución interna del electrodo de referencia, presente en el IPPG (vidrio poroso de permeabilidad de iones) poroso, podría disolverse en la muestra o reaccionar con la muestra medida, y podría Ser el motivo de la obstrucción de los porosos. Usando el portamuestras, como se muestra en el siguiente ejemplo, evitará que suceda.
Llene el soporte de la muestra con una solución de electrolito y verifique que no haya burbujas de aire sobre la unión de líquido IPPG. Si hay alguna burbuja, muévete para sacarlas. La presencia de la burbuja hace que la permeabilidad de los iones sea diferente y podría cambiar el potencial aplicado.
Luego, coloque el electrodo de referencia no acuoso en el soporte de la muestra. Establezca la posición del electrodo de referencia moviendo la junta tórica. Al llenar el portamuestras con la misma solución de electrolito de soporte, como el electrodo de referencia, el potencial aplicado se mantendrá constante.
Si desea usar el electrodo de referencia de esa manera, use la celda de voltametría SVC-2. Y, cuando se utilizará un nuevo portamuestras, manténgalo sumergido en una solución durante la noche antes de usarlo. La impregnación de la solución al poroso de IPPG, aumenta la permeabilidad del ion a través de ellos, lo que permite realizar experimentos de voltametría cíclica.
El estándar primario de potencial de electrodo es el electrodo de hidrógeno estándar (SHE), que está compuesto por un electrodo de Pt de alta área superficial sumergido en una solución ácida que contiene protones y gas hidrógeno de actividad estándar (H + y H 2 de actividad = 1) (Figura 1 que se muestra a continuación ). El electrodo de Pt se utiliza debido a su alta actividad para la reacción redox del hidrógeno. La superficie del electrodo de Pt se platina para mejorar aún más la actividad al aumentar el área de la superficie. Para mantener el contenido de H2 en estado estable, el gas de hidrógeno debe continuar fluyendo a través de la solución interna mediante burbujeo.
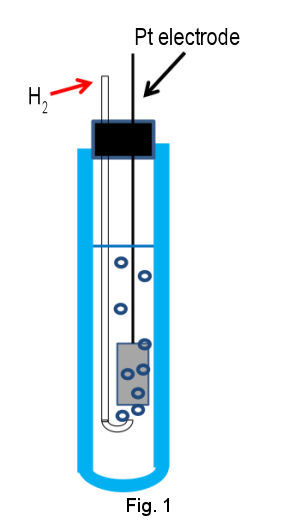
El potencial del electrodo depende de la concentración de protones (actividad, un H + ) y la presión parcial de hidrógeno ( p H 2 ) de acuerdo con la ecuación (2).
Sin embargo, SHE no es conveniente en el uso práctico. Esa es una razón por la cual los otros electrodos ya mencionados se emplean para el uso diario. Incluso si se usa el otro electrodo de referencia, hay muchos casos para informar sobre la escala SHE después de convertir el valor experimental en la escala SHE utilizando una diferencia bien conocida. Por ejemplo, en el caso de usar SCE, SHE = SCE + 0.241 etc.
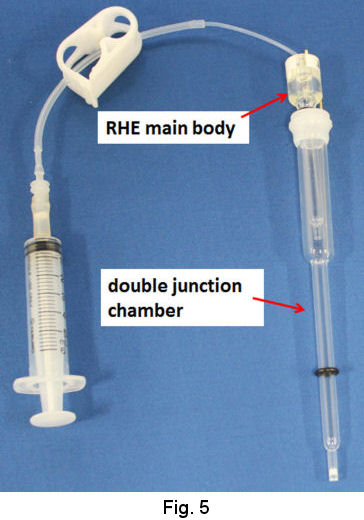
Existe un método conveniente para obtener un SHE aproximado durante un corto período de tiempo, denominado electrodo de hidrógeno reversible (RHE), en otras palabras, electrodo de hidrógeno relativo. El disponible comercial (RHEK), que está disponible por BAS Japón, se utiliza para uso temporal. Básicamente consiste en producir gas hidrógeno en el propio electrodo de referencia en cada momento de experimento por usuario. El hidrógeno evolucionado en el electrodo de platino en solución de ácido fuerte (HCl 1,2 M o 0,5 MH 2 SO 4).) Por polarización catódica se almacena temporalmente en la cámara del electrodo de referencia. Aunque su propósito es el uso en una solución de analito de ácido fuerte, también se puede usar en una solución neutra mediante el uso conjunto de la cámara de doble unión. Está certificado por la comparación con el electrodo de referencia SCE y Ag-AgCl que este RHE indica aproximadamente el mismo potencial de SHE.
Los procedimientos operativos de RHEK se muestran a continuación. En el caso de la solución de prueba de ácido fuerte, después de extraer la solución de ácido fuerte en el tubo del cuerpo principal de RHE (Fig. 2), deje que el hidrógeno gaseoso se desprenda por electrólisis catódica y almacene H 2 en el cuerpo principal de RHE (Fig. 3) . Luego, puede ejecutar su propósito principal después de devolver el terminal de trabajo que se ha utilizado en H 2 evolución, al electrodo de trabajo en su solución de prueba y al intercambio del terminal de referencia que se ha conectado al contraelectrodo junto con el terminal del contador (Fig. 4).
 |
 |
 |
En el caso de ácido moderado y solución neutra o incluso una solución ácida fuerte, se recomienda el uso de cámara de doble unión (Fig. 5). La evolución del gas de hidrógeno se realiza en la cámara de unión mediante un procedimiento similar al mencionado anteriormente. Como la cámara de unión tiene una frita en su punta, la unión misma se puede quitar de la solución ácida fuerte para transferirla a la solución de prueba. Luego, el RHE combinado con la unión se utiliza como electrodo de referencia ordinal (Fig. 6).

Algunas veces se emplea NaCl en lugar de KCl, cuando el anión perclorato está involucrado en la solución de prueba. La razón es que la solubilidad del perclorato de potasio es bastante baja, mientras que la del perclorato de sodio es aproximadamente cien veces más alta que la de la sal de potasio. El riesgo de deposición en la frita debido a la baja solubilidad del KClO 4 se ve disminuido por esta precaución. Cuál sea empleado podría depender de un compromiso entre la conveniencia práctica.
El soporte de muestra, que tiene frita vycor al final del tubo de vidrio, está disponible por BAS Japón. También es utilizable para un puente salino o un electrodo de referencia.