Es bien sabido que un potenciostato es esencial en las mediciones electroquímicas.
Por lo que ve, puede entenderse la razón por la cual el contraelectrodo y el electrodo de trabajo deben estar conectados a puntos completamente diferentes en términos de circuito dentro del potenciostato.
Como se mencionó en la nota técnica anterior "Contraelectrodo", en el caso del sistema de dos electrodos, es difícil diferenciar entre el contraelectrodo y el electrodo de trabajo, mientras que en el sistema de tres electrodos que usan potenciostato, se distinguen claramente.
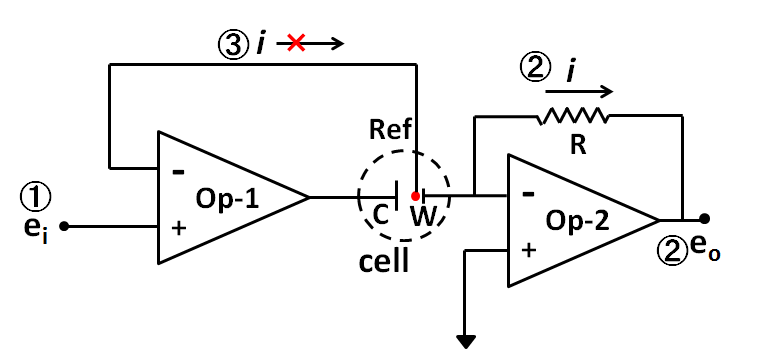
La última vez, el potenciostato podría consistir teóricamente en la combinación de al menos dos amplificadores operacionales, el establecimiento de tres funciones fundamentales (①, la regulación del potencial del electrodo de trabajo contra el electrodo de referencia, ② medir la corriente que fluye a través del electrodo de trabajo, ③ no la corriente que fluye al electrodo de referencia), y los puntos para entender la función del amplificador operacional (ambos terminales de entrada tenían el mismo voltaje y la impedancia de entrada era demasiado grande para que la corriente no pudiera entrar o salir del opero dentro de dos terminales de entrada.) se demostraron.
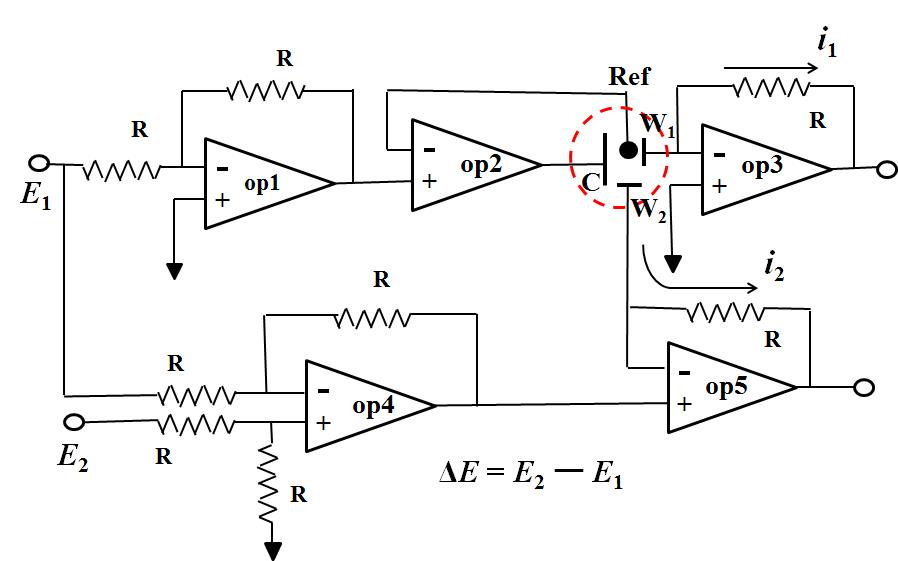
La Fig. 2 es un diagrama de circuito de cinco amplificadores operacionales del bi-potenciostato. El potencial del electrodo de trabajo 1 (W 1 ) está controlado por Op amp1 y Op amp2, que es el mismo que se describió anteriormente (solo se utilizó un amplificador operacional en el sistema óptico anterior), el potencial regulado es E 1 . Op amp4 es un circuito de resta que emite la señal de diferencia entre E 1 y E 2 , mientras que se convierte en el terminal de entrada + del amp5 OP (diferencia de señal Δ E = E 2 - E 1 ). Debido a que los voltajes del terminal de entrada + y del terminal de entrada son los mismos (descritos anteriormente), el potencial aplicado al electrodo de trabajo 2 esE 2 - E 1 . E 1 es el potencial aplicado al electrodo 1, E 2 puede seleccionarse completamente de manera independiente. Por lo tanto, el electrodo 2 puede ser controlado independientemente.
De esta manera, por ejemplo de RRDE, es posible aplicar un potencial arbitrario independientemente para el electrodo de disco y el electrodo de anillo respectivamente contra el electrodo de referencia común.
Dos puntos en la final. Un punto es un seguidor de voltaje. Op Amp 2 es eso. Como no hay otra ruta de conexión al terminal +, excepto la señal de la etapa anterior (amplificador operacional 1), casi no tiene flujo de corriente. Dado que el terminal es la única conexión al electrodo de referencia, no hay flujo de corriente allí, mientras que la corriente puede fluir como salida del amplificador (está conectado al contraelectrodo C y se convierte en corriente electrolítica). Esto provoca la posibilidad de pasar una gran corriente sin flujo de corriente, es decir, se realiza la conversión de impedancia. Se usa frecuentemente en potenciostato.
Otro punto es un circuito de resta y un circuito de suma. En el circuito de sustracción, puede ser difícil entender claramente la característica de que no hay interferencia mutua entre las señales de entrada, para el circuito de suma, las variables que se agregan están conectadas al mismo terminal de entrada, por lo que es fácil convencer su efecto.
El uso efectivo del circuito de adición para la compensación positiva de la resistencia de la solución se tratará en la próxima edición.
En las dos ediciones anteriores, se habló sobre el potenciostato y se presentará la continuación. La retroalimentación positiva es un tema aquí. Esta es una función opcional que no siempre es necesaria, pero puede seleccionar usarla, si la necesita.
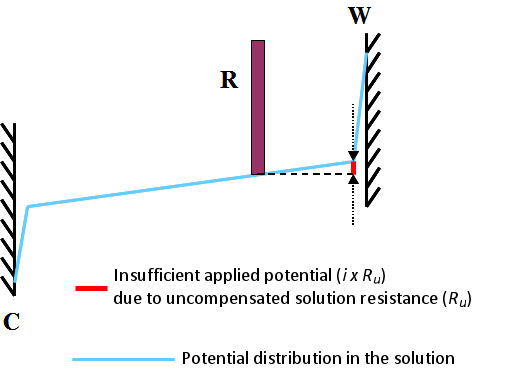
Esto comúnmente se denomina resistencia de solución no compensada y está marcado como R u . Puede representarse esquemáticamente como se muestra en la Fig. 3.1. Muestra el estado en que la corriente i fluye una celda. El subíndice u proviene del significado de "desconocido" o "incontrolable".
Incluso con un potenciostato, tal caída potencial no puede controlarse completamente. La única alternativa es lidiar con métodos incompletos con comentarios positivos como se describe a continuación.
El efecto desfavorable causado por esta resistencia de la solución no compensada es, por ejemplo, un cambio de potencial máximo y una extensión adicional del ancho del potencial máximo en una medición de CV (Voltametría cíclica).
La desviación del potencial pico provoca una diferencia entre los valores absolutos de la corriente pico de oxidación y la corriente pico de reducción, y el potencial redox estimado a partir del promedio de los dos potenciales pico se desviará ligeramente. Además, la velocidad de transferencia de electrones calculada a partir del ancho potencial máximo será más lenta. Por esta razón, es necesario reducir el efecto de la resistencia de la solución no compensada. El método es retroalimentación positiva.
El circuito de retroalimentación positiva se puede configurar con tres amplificadores operacionales como se muestra en la Fig. 3.2. Se agrega un circuito aditivo (op 1) al prototipo del circuito básico (configurado por dos amplificadores operacionales) que se mencionó anteriormente.
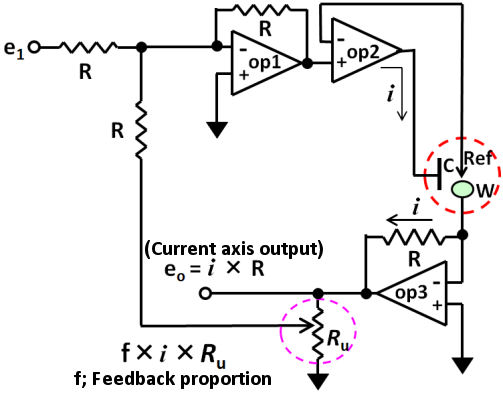
En la última edición, se mencionó la retroalimentación positiva y el potenciostato para medir la resistencia de la solución no compensada (R u ), mientras que, considerando que puede haber algunas personas, querrá saber cómo el potenciostato podría medir el R u , por lo tanto, nos gustaría hacer queda claro en este tema.
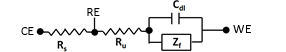
Z f es la impedancia de Faraday relacionada con la reacción redox de las especies activas (sin considerar la impedancia de difusión de las especies activas) en solución.
La resistencia de la solución incluye la resistencia (R s ) entre el contraelectrodo y el electrodo de referencia, y la resistencia (R u ) entre el electrodo de referencia y el electrodo de trabajo, que atraviesa el electrodo de referencia (generalmente representado por Rs, Ru, respectivamente). El potenciostato puede considerar el Rs pero no puede reconocer el R u (por lo tanto, la caída potencial debida al producto de la corriente que fluye en la celda y la resistencia de la solución no compensada i x R u no puede ser controlada por el potenciostato).
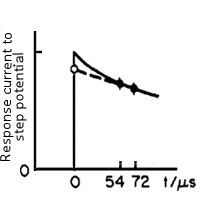
La corriente de respuesta se puede expresar mediante una función exponencial con la constante de tiempo de R u C dl (la siguiente ecuación).
Cuando t = 0, la función exponencial es 1, entonces i (0) = ΔE / R u . Es decir, si el valor actual se obtiene inmediatamente después de la aplicación del potencial, ya que ΔE es un valor establecido y se conoce (por ejemplo, cuando se establece en 50 mV), se puede obtener el valor de R u .
El valor actual en el tiempo cero se mide de la manera que se muestra en la Fig. 4-2, es decir, el valor actual en dos puntos después del paso potencial (52 y 72 microsegundos en la Fig. 4-2) se mide y se aproxima extrapolando a tiempo cero.
Cuando la constante de tiempo de la celda (dada por R u × C dl ) es menor que el tiempo de subida del potenciostato, el error puede ser grande, cualquiera que sea, tal caso significa que R u es pequeño y casi no hay necesidad de Compensación iR
La retroalimentación positiva se realiza utilizando la resistencia en solución R u obtenida de esta manera. Dado que R u está muy afectado por la posición del electrodo de referencia, es conveniente colocarlo lo más cerca posible del electrodo de trabajo y tener cuidado de no variar para cada medición. Bajo el minuto de corriente del microelectrodo, ya que la influencia es pequeña, el problema de la resistencia de la solución es pequeño. En la electrólisis a granel con una gran cantidad de corriente, hay un margen en el ajuste potencial, por lo que hay relativamente menos problemas. Tenga en cuenta que la compensación i R causa inestabilidad del potenciostato, si se trata de una gran cantidad de compensación.
Normalmente se utiliza un método que utiliza el CV para obtener la tasa de transferencia de electrones (k s ), que se anunció hace unos 50 años (Ref. 5-1).
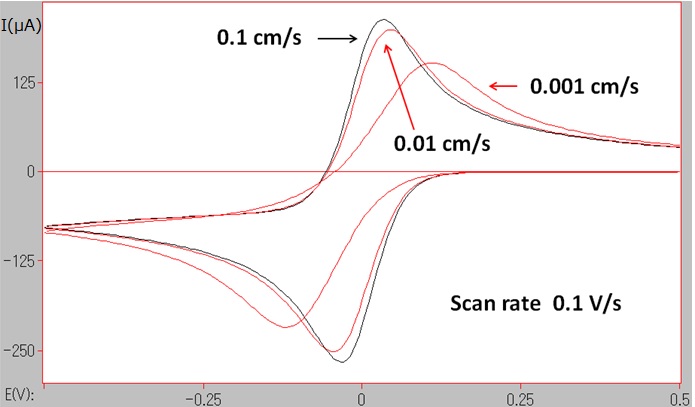
Examinar dicho parámetro cinético, así como investigar el potencial redox que es un parámetro termodinámico, son los objetivos importantes en las mediciones electroquímicas.
Incidentalmente, el ancho potencial máximo (Δ E p ) no solo cambia debido a la velocidad de transferencia de electrones, sino que también la resistencia de la solución no compensada puede influir enormemente. Hasta ahora esto ha sido mencionado varias veces.
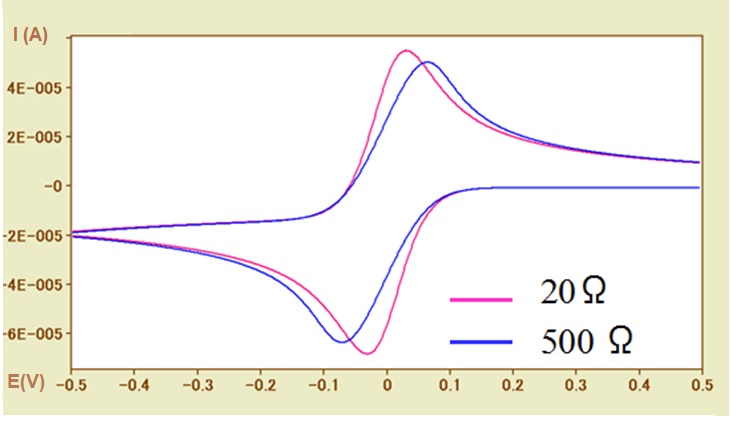
Tal situación se puede mostrar en la Figura 5-2. por simulación de CV.
En el caso de un sistema de reacción de velocidad de transferencia electrónica rápida (k s = 0.1 cm / s), se comparan las curvas CV de las resistencias de solución no compensadas de 20Ω (línea rosa) y 500Ω (línea azul). Con el aumento de la resistencia de la solución, la ampliación de la amplitud del pico de potencial (Δ E p ) depende de la resistencia de la solución, que se puede observar de manera similar a la influencia de la tasa de transferencia de electrones. Lo necesario para examinar si la resistencia de la solución influye en la determinación de la velocidad de transferencia de electrones debe anotarse aquí.
Además, el potencial redox se calcula utilizando el valor promedio del potencial máximo. Sin embargo, la diferencia de potencial entre el pico de oxidación y el pico de reducción es causada por la resistencia de la solución y, por lo tanto, la posibilidad de desigualdad debe considerarse también (aunque es un asunto trivial). En otras palabras, los valores absolutos de los valores de corriente máxima de oxidación y reducción no son exactamente los mismos.
En la Fig. 5-2, la corriente de referencia del pico de oxidación es un valor negativo, por lo que el valor absoluto de la corriente de pico de oxidación es menor que el de la corriente de pico de reducción con la corriente de referencia de cero.
Dado que la influencia de la resistencia de la solución en el cambio de potencial es efectiva en el resultado de la resistencia de la solución actual (I) × (R) (caída de IR), por lo tanto, el valor actual también es bastante importante. Al reducir la concentración de las especies electroactivas, o al disminuir el área de superficie del electrodo (en el caso extremo, se puede usar el microelectrodo), etc. para reducir el valor actual, luego para juzgar si hay algún efecto de la resistencia de la solución.
Referencia:
5-1) RS Nicholson, Anal. Chem. , 37 , 1351 (1965).
Uno de los propósitos de la medición electroquímica es comprender el potencial redox del sujeto. El potencial de oxidación-reducción es un rasgo característico de las moléculas que puede usarse para la identificación y caracterización de las sustancias. Así es como se determina el potencial redox. Si sabe esto, puede usarlo como una guía para diseñar una sustancia con un potencial redox deseado.
Los electrones de la capa externa de la sustancia (considerando las especies moleculares aquí) ocupan el nivel de energía electrónica (también llamado orbital) en el turno desde el nivel bajo hasta el nivel alto. El nivel de energía más alto ocupado se define como el nivel más alto ocupado (HOMO; H ighest O ccupied M MOLECULAR O rbital), el nivel de energía desocupado por encima de ella se denomina molecular desocupado más bajo orbital (LUMO: L owest U noccupied MMOLECULAR O rbital) Estos niveles de energía electrónica están involucrados en la reacción de las especies moleculares.
Por esta razón, HOMO y LUMO también se denominan niveles de frontera. Con respecto a las reacciones electroquímicas, la oxidación consiste en eliminar electrones del HOMO y la reducción es agregar electrones a LUMO.
Debido a que el nivel electrónico es la característica inherente de la sustancia, el potencial redox también es un valor único de la sustancia. Formalmente, se denomina potencial de reducción potencial de oxidación o de fórmula cantidad de reducción de oxidación estándar, pero aquí se expresa como potencial redox (redox es una combinación de rojo ucción y buey idation).
Dado que el potencial redox de una especie molecular depende de las ubicaciones del HOMO - LUMO, es posible obtenerlo mediante el cálculo mecánico teórico cuántico. Sin embargo, también puede ser importante comprender qué factores afectan el potencial redox en la calidad. Por este motivo, será descrito varias veces después.
HOMO, LUMO puede determinar el potencial redox y causar la fluctuación potencial redox. El factor de fluctuación para el nivel de energía electrónica es principalmente la densidad de electrones en el centro redox (el sitio donde se realiza la transferencia de electrones), la carga eléctrica a su alrededor (positiva, negativa, su tamaño) y la influencia del medio se agrega como otro factor también. Cuando se utiliza un compuesto organometálico como material, se puede considerar su caracterización.
En primer lugar, consideremos el aumento o la disminución de la densidad de electrones del centro redox (sitio). Por ejemplo, cuando la densidad de electrones del centro redox aumenta debido a la influencia de un sustituyente (grupo donador de electrones), el nivel de electrones aumenta (se vuelve inestable) y el potencial redox se desplaza fácilmente a la dirección negativa, lo que lo hace fácil para ser oxidado Por otro lado, si la densidad electrónica se reduce por un sustituyente (grupo que retira electrones), ocurrirá la situación opuesta.
Por ejemplo, comparemos el grupo acetilo y el grupo metilo como los sustituyentes del ferroceno. El primer grupo acetilo es un grupo que retira electrones y reduce la densidad de electrones alrededor del hierro, que es un sitio redox, y el grupo metilo es un grupo donador de electrones. Su efectividad es casi directamente proporcional al número de sustituyentes. El potencial redox del ferroceno se desplaza al positivo en 0.25 V cuando un sustituyente acetilo y 0.47 V se desplaza positivamente cuando el sustituyente grupo diacetilo. Por otro lado, hay un cambio negativo de 500 mV cuando el ferroceno está sustituido con deca-metilo (cuando todos los átomos de hidrógeno son reemplazados por grupos metilo). Un cambio negativo de 50 mV es causado por cada grupo metilo.
Las dos personas fueron responsables de la síntesis y purificación del ferroceno y varios derivados del ferroceno, el rutenoceno y el osmoceno. En ese momento, la voltametría cíclica no era tan popular como ahora, y Kuwana adoptó la cronopotenciometría (CP) que registraba el cambio del potencial del electrodo de trabajo en función del tiempo aplicando un flujo de corriente constante. Aunque el CP no se usa a menudo hoy en día, no es necesario el control de realimentación del potencial del electrodo, y una vez que el potencial del electrodo se pueda registrar correctamente, es un método suficientemente simple. El potencial redox se puede obtener a partir del tiempo de transición de CP.
Al principio, Kuwana usó un electrodo de mercurio, sin embargo, debido al flujo de corriente de fondo demasiado grande, se usó un electrodo de platino como electrodo de trabajo alternativo. En ese momento, su supervisor era Ralph Adams, un conocido pionero en el trabajo de investigación de electrodos sólidos, reemplazar el electrodo de trabajo por un electrodo de platino era algo natural.
Curiosamente, no había nombre de supervisor en el periódico de Kuwana. Los detalles que incluyen esta anécdota se pueden encontrar en las reseñas de Bill Geiger 7-4) . Recientemente, yo (Watanabe) le envié un correo electrónico a Kuwana y recibí la respuesta de él. Una parte de la respuesta fue citada como “Hicimos la mayor parte del trabajo durante las vacaciones de Semana Santa. La facultad amablemente nos dejó publicar sin sus nombres en los papeles. Generoso e inusual, no hace falta decirlo ". También fue un artículo interesante que reveló la importancia del potencial redox del ferroceno que podía controlarse mediante sustituyentes.
Referencia:
7-1) Wilkinson, G., J. Am.Chem.Soc. 74, 6146 y 6148, (1952)
7-2) Página, JA, Wilkinson, GJAm.Chem.Soc., 74,6149, (1952)
7-3) Kuwana, T., Bublitz, DE, Hoh, GJAm .Chem.Soc., 82, 5811, (1960)
7-4) Geiger WE, Organometallics 26, 5738 (2007)
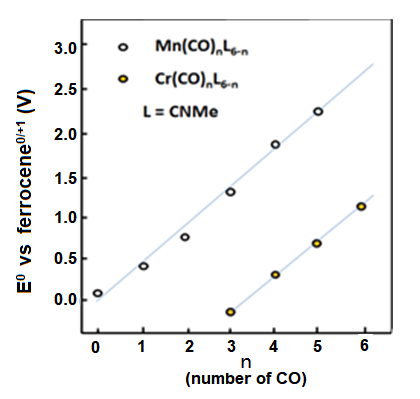 Fig. 8-1 El cambio de potencial redox de los compuestos de manganeso y cromo cuando los grupos carbonilo sustituyen al isocianato de metilo.
Fig. 8-1 El cambio de potencial redox de los compuestos de manganeso y cromo cuando los grupos carbonilo sustituyen al isocianato de metilo.
El potencial redox reversible de ciclopentadienil manganeso tricarbonilo (1) es de 0,92 V frente al ferroceno de referencia.
El espectro IR en la región carbonilo durante la oxidación electrolítica en masa se muestra en la Fig. 8-3.
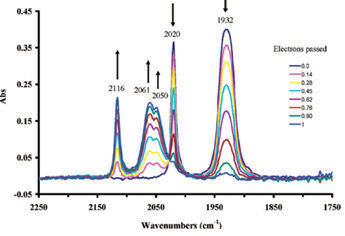
A medida que avanza la oxidación electrolítica, la intensidad de absorción de dos picos que pertenecen a 1 en el lado del número de onda bajo (1930 cm- 1 , 2020 cm- 1 ) disminuye, mientras que tres picos (2050 cm- 1 , 2061 cm- 1 , 2116 cm ) 1 ) pertenecientes a 1 + aparecen en el lado del número de onda alto y su intensidad de absorción aumenta gradualmente.
La oxidación electrolítica hace que la intensidad de los electrones disminuya alrededor del manganeso, por lo que la donación de electrones disminuye. Por lo tanto, el enlace Mn-CO se debilita; en el país indicar la mejora de los bonos CO. Los potenciales redox de los compuestos 2 y 3 (Fig. 8-2) con sustituciones amino o metilo en los anillos de ciclopentenilo están en la dirección negativa en comparación con el compuesto 1 .
Esto se debe a la propiedad de los sustituyentes de suministro de electrones, que aumenta la donación de electrones desde el metal central al ligando CO, y el número de onda de CO es bajo, en el espectro IR de la frecuencia de estiramiento de CO (ver tabla siguiente ).

Referencia:
8-1) WE Geiger et al., J. Am. Chem. Soc. , 130 , 9859 (2008)